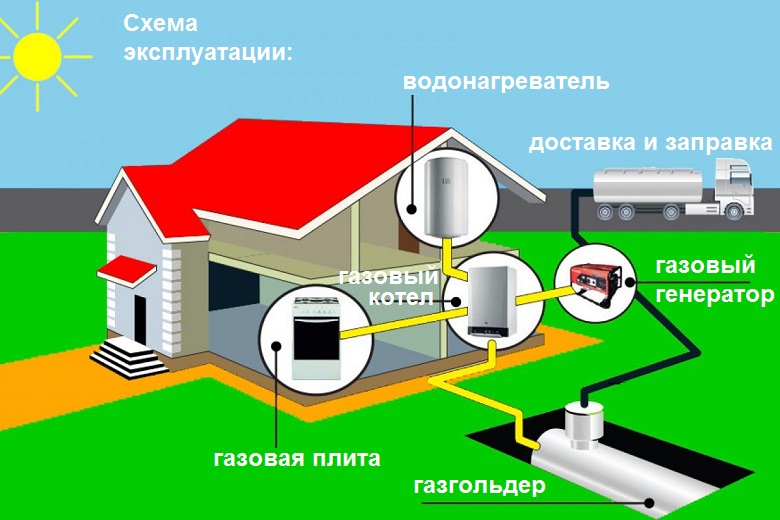
Газ со
Содержание
- CHEMEGE.RU
- Оксид углерода (II).
- Строение окида углерода (II) .
- Получение окида углерода (II) .
- Химические свойства окида углерода (II).
- Угарный газ
- Строение молекулы
- История открытия
- Монооксид углерода в атмосфере Земли
- Получение
- Физиологическое действие, токсичность
- Свойства
- Определение монооксида углерода
- Применение
- См. также
- Литература
- Ссылки
CHEMEGE.RU
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
H2C2O4 → CO + CO2 + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН4+О2 → 2СО + 4Н2
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н2 → СН3ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксид углерода (II).
Оксид углерода (II) – СО – является одним из основных кислородосодержащих соединений углерода. Оксид углерода (II) – угарный газ – соединение без запаха и цвета, горит голубоватым пламенем, легче воздуха и плохо растворим в воде.
СО – несолеобразующий оксид, но при пропускании в расплав щелочи при высоком давлении образует соль муравьиной кислоты:
СО + KOH = HCOOK,
Поэтому СО часто считают ангидридом муравьиной кислоты:
HCOOH = CO + H2O,
Реакция протекает при действии концентрированной серной кислоты.
Строение окида углерода (II) .
Степень окисления +2. Связь выглядит следующим образом:

Стрелкой показана дополнительная связь, которая образуется по донорно-акцепторному механизму за счет неподеленной пары электронов атома кислорода. Из-за этого связь в оксиде очень прочная, поэтому оксид способен вступать в реакции окисления-восстановления только при высоких температурах.
Получение окида углерода (II) .
1. Получают его в ходе реакции окисления простых веществ:
2C + O2 = 2CO,
C + CO2 = 2CO,
2. При восстановлении СО самим углеродом или металлами. Реакция идет при нагревании:
Химические свойства окида углерода (II).
1. В нормальных условиях оксид углерода не взаимодействует с кислотами и с основаниями.
2. В кислороде воздуха оксид углерода горит голубовытым пламенем:
2СО + О2 = 2СО2,
3. При температуре оксид углерода восстанавливает металлы из оксидов:
FeO + CO = Fe + CO2,
4. При взаимодействии оксида углерода с хлором образуется ядовитый газ — фосген. Реакция идет при облучении:
Угарный газ
Угарный газ
| Монооксид углерода | |
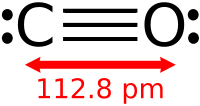 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Монооксид углерода |
| Химическая формула | CO |
| Отн. молек. масса | 28.0101 а. е. м. |
| Молярная масса | 28.0101 г/моль |
| Физические свойства | |
| Плотность вещества | 0,00125 (при 0°C) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −205 °C |
| Температура кипения | −191,5 °C |
| Энтальпия (ст. усл.) | −110,52 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0.0026 г/100 мл |
| Классификация | |
| номер CAS | |
Монооксид углерода (лат. Carbon monoxide; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
Регистрационные номера:
- ICSC 0023
- RTECS FG3500000
- ООН 1016
- EC 006-001-00-2
Классификация ООН
- Класс опасности ООН 2,3
- Вторичная опасность по классификации ООН 2,1
Строение молекулы
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2Oσ2zπ4x, yσ2C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
Молекула слабо поляризована, электрический момент её диполя μ = 0,04·10-29Кл·м (направление дипольного момента O-→C+). Ионизационный потенциал 14,0 в, силовая константа связи k = 18,6.
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Монооксид углерода в атмосфере Земли
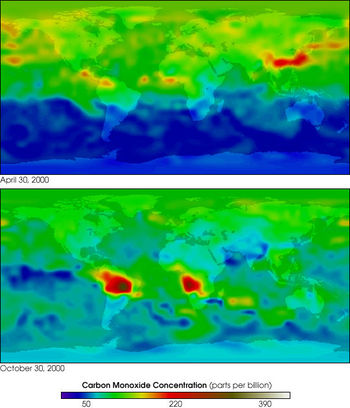 Содержание CO в атмосфере Земли по данным MOPITT
Содержание CO в атмосфере Земли по данным MOPITT
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2C + O2 → 2CO (тепловой эффект этой реакции 22 кДж),
2. или при восстановлении диоксида углерода раскалённым углём:
CO2 + C ↔ 2CO (ΔH=172 кДж, ΔS=176 Дж/К).
Эта реакция часто происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ». Картина протекающих в печи реакций приведена на схеме.
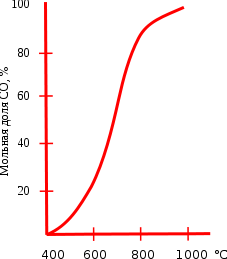
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
HCOOH →(t, H2SO4) H2O + CO
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
HCOOH + ClSO3H → H2SO4 + HCl + CO.
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
H2C2O4 →(t, H2SO4) CO + CO2 + H2O.
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
K4 + 6H2SO4 →(t) 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO.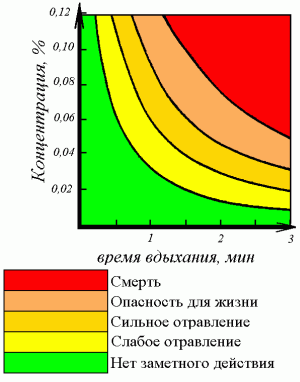 Токсическое действие CO на человека
Токсическое действие CO на человека
Физиологическое действие, токсичность
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаками отравления служат головная боль, головокружение и потеря сознания. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее, чем кислород (при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки кислорода и клеточного дыхания. Предельно допустимая концентрация монооксида углерода в воздухе промышленных предприятий составляет 0,02 мг/л. Концентрация более 0,1 % — смертельна. В выхлопе бензинового автомобиля допускается до 1,5-3 %.
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
Свойства
Монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
| Стандартная энергия Гиббса образования ΔG | −137,14 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 197,54 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 29,11 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 0,838 кДж/моль |
| Энтальпия кипения ΔHкип | 6,04 кДж/моль |
| Критическая температура tкрит | −140,23°C |
| Критическое давление Pкрит | 3,499 МПа |
| Критическая плотность ρкрит | 0,301 г/см3 |
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
H2O + CO ↔ CO2 + H2 + 42 кДж
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
CO + 1/2O2 → 2CO2 ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
CO + Cl2 → COCl2
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
(FCO)2O2 + 2KI → 2KF + I2 + 2CO2
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
CO + S → COS ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
Восстанавливает SO2:
SO2 + 2CO → 2CO2 + S
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
CO + KOH → HCOOK
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
2K + 2CO → K+O-—C2—O-K+
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
CO + NH3 → H2O + HCN
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
PdCl2 + H2O + CO → CO2 + 2HCl + Pd↓
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
5CO + I2O5 → 5CO2 + I2
Применение
- Моноксид углерода применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса (en:Clear smoke или en:Tasteless smoke технология). Допустимая концентрация CO равна 200 мг/кг мяса.
- Инсульт (ОНМК) — новые методы лечения.
См. также
- Водяной газ
- Выхлопные газы
- Генераторный газ
- Диоксид углерода
- Диоксид триуглерода
- Синтез-газ
- Смешанный газ
- Отравление угарным газом
- Сигареты
Литература
Ссылки
- Международная карта химической безопасности для монооксида углерода
Оксид углерода(II) – СО
(угарный газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):

В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
Видео — опыт «Получение угарного газа»

C + O2 = CO2 + 402 кДж
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С + Н2О = СО + Н2 – Q,
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C, H2SO4 → H2O + CO
H2C2O4 t˚C,H2SO4→ CO + CO2 + H2O
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) с кислородом
2C+2O + O2 t˚C → 2C+4O2
2) с оксидами металлов CO + MexOy = CO2 + Me
C+2O + CuO t˚C → Сu + C+4O2
3) с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* реагирует с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
ЗАКРЕПЛЕНИЕ
№1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
«Угореть может каждый, я сам чуть не отравился на вызове»
Мы поговорили с опытным врачом анестезиологом-реаниматологом, который имел дело с подобным случаем. Пытаясь спасти уже бессознательного ребенка, он сам чуть не погиб от угарного газа.
— Это было в 2012 году, — вспоминает врач скорой медицинской помощи из Бобруйска Константин Толстоногов. — Родители нашли дочь в ванной без сознания. Когда мы приехали, она лежала на диване — зрачки широкие, дыхания и сердцебиения нет. Никакого запаха в квартире, семья благополучная, на суицид не похоже. Но подозрение, что что-то не так возникло сразу. Тело девочки было не бледное, не синеватое, а розовое, такое бывает при отравлении угарным газом. В квартире была газовая колонка — фирменная, исправная, автоматическая. Никаких проблем, по словам родителей девочки, с ней никогда не было, и мы как-то исключили эту угрозу. 28-я минута реанимации. Результата нет. И тут мы все поплыли. Слабость, сонливость, одышка, в голове пульсирует… До нас дошло – это угарный газ. Все вон из квартиры. Лично я бежать уже был не в силах, лег прямо на лестничной площадке…
По нашей просьбе врач-реаниматолог ответил на наши вопросы о смертельном газе.
Что такое угарный газ?
— Продукт неполного сгорания любого топлива, в составе которого есть углерод — бензина, солярки, мазута, природного газа, угля, дров… Образоваться может абсолютно везде. При полном сгорании органики образуются двуокись углерода (CО2) и вода. Но если в процессе горения не хватает кислорода, образуется недоокисленный монооксид углерода — угарный газ (СО).
Чем опасен угарный газ?
— При содержании только 0,08 % в воздухе человек чувствует головную боль и удушье. При концентрации 0,32 % возникает паралич, потеря сознания, смерть наступает через 30 минут. При концентрации выше 1,2 % сознание теряется после нескольких вдохов, человек умирает менее чем через 3 минуты.
Где опасность появление угарного газа наиболее высока?
— В квартирах с газовыми колонками, газовыми плитами, гаражах и подвалах, особенно если там велись какие-либо ремонтные работы. В банях и частных домах с печным отоплением, где часто, не дождавшись полного сгорания дров, закрывают заслонку.
Как распознать угарный газ?
— Ни цвета, ни запаха у него нет. Если почувствовали слабость, сонливость, учащенное сердцебиение, сознание поплыло – это сигнал. Сразу уходите из помещения на воздух. Угарный газ быстро и плотно связывается с гемоглобином, и он уже не может переносить кислород. Наступает кислородное голодание. От него тут же страдает центральная нервная система и сердечно-сосудистая система.
Что делать, чтобы не угореть?
— Следить за исправностью оборудования и вентиляции, перед каждым использованием газового оборудования проверять тягу, как можно чаще открывать окна, предельно аккуратно топить печку.
А В ЭТО ВРЕМЯ
«Если использовать газовое оборудование правильно, ничего не случится»
— В квартирах белорусов больше 100 тысяч газовых колонок. Если они потенциально опасны, почему бы их не убрать?
— Если в домах стоят газовые колонки, скорее всего, дом построен в 60-80 годы прошлого века, и, значит, в то время там невозможно было организовать централизованную подачу горячей воды, — прокомментировал «Комсомолке» заместитель главного инженера УП «МИНСКОБЛГАЗ» Сергей Бородавко. — Чтобы демонтировать газовые колонки, нужно проводить к дому трубы водоснабжения. Это дорого и технически сложно. Такая задача сейчас не стоит. Но, поверьте, если колонка исправна и она правильно эксплуатируется, никакой угрозы она не несет.
— А как самому определить, имеется ли тяга или нет?
— В каждой газовой колонке есть специальные окошки или прорези, к которым необходимо поднести зажженную спичку или свечу, чтобы проверить наличие тяги в дымоходе. Если пламя отклоняется внутрь, все нормально, тяга есть. Если нет – непорядок. Чтобы проверить вентиляционный канал – к нему можно поднести листок бумаги. Если тот прилипает к вентиляционной решетке – вентиляция работает.
— У газовиков есть приборы, которыми можно измерить концентрацию угарного газа?
— Газовики определяют только концентрацию сжиженного и природного газа. Приборы, которые способны уловить угарный газ, возможно, есть в МЧС или других организациях, проверяющих исправность дымоходов и вентиляционных каналов.
— Одна из возможных причин, по которой в доме в Борисове скопился угарный газ – забитый дымоход. Дымоходы есть в каждом доме или только в тех, где установлено газовое оборудование?
— Дымоходы есть везде, где нужно обеспечить отвод продуктов горения, в том числе и в домах с газовыми колонками и котлами. В большинстве случаев – это частные дома, а также многоэтажные жилые дома с поквартирным отоплением.
— А кто несет ответственность за своевременную проверку и исправность дымоходов?
— Согласно Правилам пользования газом в быту обязанность по проведению проверки состояния дымовых и вентиляционных каналов возложена на организации, осуществляющие эксплуатацию жилищного фонда или предоставляющие жилищно-коммунальные услуги, а также на потребителей газа. По их заявкам специализированные организации, которые имеют соответствующие разрешения, проводят проверки работоспособности дымоходов и вентканалов. Газоснабжающая организация не занимается проверкой дымовых и вентиляционных каналов. А вот техобслуживание газовых колонок проводит именно она.
КСТАТИ
Обнаружить выделяющиеся при тлении и горении материалов, в том числе и угарный газ, поможет газовый извещатель: он вовремя запищит и сообщит об опасности. Цена – около 200 тысяч рублей.